肠道菌群在宿主生理、发育和免疫中具有多种作用。虽然被上皮细胞限制在肠腔内,但微生物通过不明确的机制影响远端系统。已经证实,肠道微生物群与肿瘤免疫治疗的疗效有关。这些影响被认为是由细菌来源的代谢产物或细胞壁成分(如短链脂肪酸、胞外多糖、肌苷、肽聚糖和吲哚-3-甲醛)激活抗肿瘤免疫反应而引发的。近年来,细胞外囊泡在种间交流中的作用逐渐被发现,但它们是否参与系统微生物与宿主的相互作用尚不清楚。
近日,8827太阳集团官网曹崇江/程抒劼团队研究发现鼠李糖乳杆菌LGG来源的胞外囊泡(LGG-EV)能够调节小鼠的肠道微生态、改善肿瘤组织免疫抑制微环境,与免疫检查点抑制剂PD-1药物联用后可以提高肿瘤免疫治疗的效果。相关研究成果以“Dietary Lactobacillus rhamnosus GG extracellular vesicles enhance antiprogrammed cell death 1 (anti-PD-1) immunotherapy efficacy against colorectal cancer”为题在工学学科期刊《Food & Function》杂志发表(封面文章)。8827太阳集团官网硕士生陆顺为本文的第一作者,太阳集团电子游戏为本文的第一通讯单位。
本研究首先利用超滤结合超高速离心法获取了LGG-EV,并且对高产LGG-EV的培养条件进行了优化。为了进一步确定LGG-EV的口服效果,通过体内体外验证了LGG-EV在Ca2+环境下具有更好的消化道稳定性和肠道停留时间。机理方面,LGG-EV通过提高肠系膜淋巴结中CD8+ T/CD4+ T细胞的比例,以及提高肿瘤组织中MHC II+ DC细胞、CD4+ T细胞和CD8+ T细胞的比例来调节肠道免疫。此外,联合治疗小鼠肠道微生物群的多样性和乳酸杆菌等有益菌的丰度均有所增加,与抗肿瘤作用相关的血清代谢物水平也发生了显著变化,例如尿苷、1D-手性肌醇以及维生素B2等的水平在联合治疗后均有所升高。该研究阐述了鼠李糖乳杆菌LGG来源的胞外囊泡对肿瘤免疫治疗的协同作用,为将LGG-EV 作为后生元制剂与免疫检查点抑制剂联合用于癌症治疗的产品开发奠定了理论基础。
原文链接:https://pubs.rsc.org/en/content/articlelanding/2023/FO/D3FO02018E

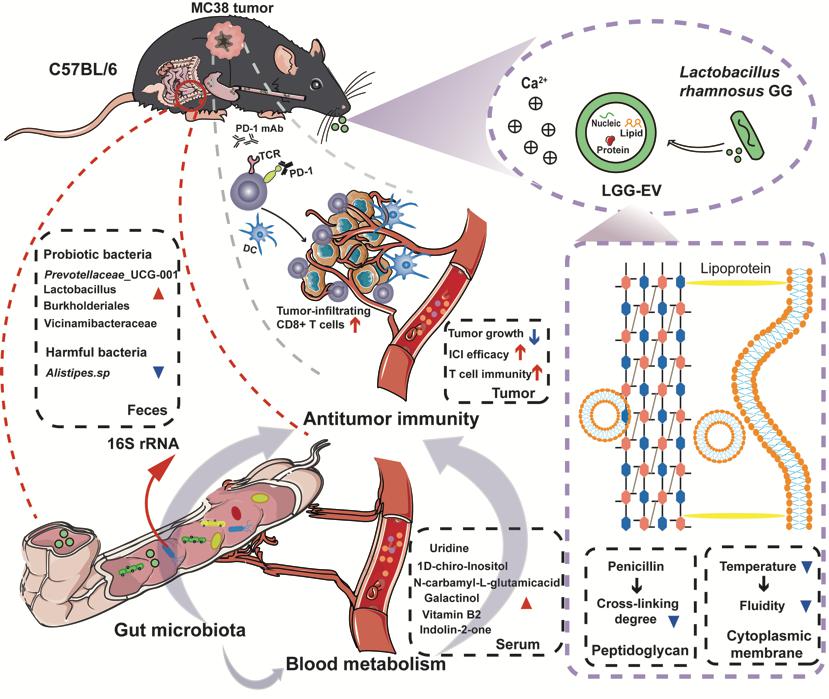
膳食鼠李糖乳杆菌胞外囊泡(LGG-EV)协同增强抗PD-1免疫疗法的疗效
(供稿单位:8827太阳集团官网食品营养与安全系,撰写人:程抒劼)

